Badania runa leśnego
Badania runa leśnego wykonywane są co 5 lat na wszystkich SPO II rzędu, również na powierzchniach pozbawionych drzewostanu lub z drzewostanem w fazie uprawy bądź młodnika.
Zakładanie (odnawianie) powierzchni próbnych
- Powierzchnie monitoringu szaty roślinnej zbiorowisk leśnych są położone w obrębie SPO II rzędu w drzewostanach iglastych – sosnowych i świerkowych oraz liściastych – dębowych i bukowych. Stałą powierzchnię obserwacyjną szaty roślinnej stanowi prostokąt o powierzchni 800 m2 i wymiarach 20x40 m, podzielony na osiem kwadratów o wymiarach 10xl0 m każdy (for. 1, ryc. 1). Wyznaczona jest ona w dowolnym miejscu SPO II rzędu, charakteryzującym się niezniszczonym runem, przeciętnym drzewostanem oraz przeciętnym zadrzewieniem. Cztery kwadraty oznaczone numerami 1, 2, 3, 4 tworzą podstawową powierzchnię obserwacyjną runa, a kwadraty o numerach 2, 3, 5, 8 stanowią powierzchnię służącą do obserwacji odnowień naturalnych. Kwadraty oznaczone na szkicu numerami 2, 3, 5, 8 należy podzielić na 16 kwadratów (pól) o boku 2,5 m każdy, kwadrat oznaczony na szkicu numerem 1 należy podzielić na 25 kwadratów o boku 2,0 m każdy.

Fot. 1. Powierzchnia do badań runa leśnego w drzewostanie sosnowym
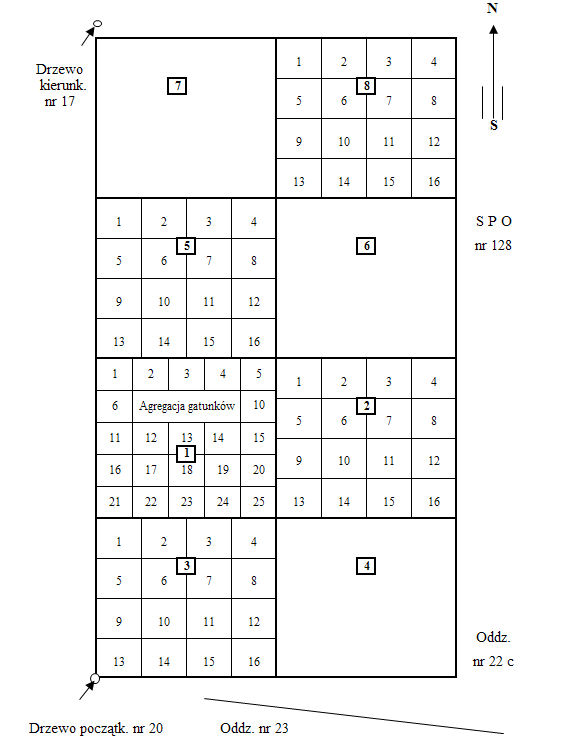
Rycina 1. Szkic powierzchni monitoringu szaty roślinnej runa leśnego i odnowień naturalnych.
- Na powierzchni monitoringowej prowadzi się jedynie obserwacje i badania nieniszczące, tzn. nie pobiera się prób gleby, ściółki, roślin zielnych czy drzew.
- Po założeniu powierzchni wykonuje się podstawowy opis dokumentacyjny, na który składa się szkic położenia powierzchni monitoringu szaty roślinnej z numerami drzew kierunkowych (w obwódkach), domiarami do punktów charakterystycznych, z numerem powierzchni SPO II rzędu oraz z numerami oddziałów i literami pododdziałów. W dokumentacji zamieszcza się również fragment mapy drzewostanowej i siedlisk z powierzchnią monitoringową zaznaczoną w części centralnej.
Opis florystyczno-fitosocjologiczny
- Opis florystyczno-fitosocjologiczny polega na wykonaniu zdjęcia fitosocjologicznego uzupełnionego pomiarem wysokości drzew.
- Zdjęcie fitosocjologiczne wykonuje się na wyznaczonej powierzchni 400 m2 (20 x 20 m) obejmującej kwadraty: 1, 2, 3 i 4 (patrz szkic powierzchni, ryc 1).
- Najlepszą porą do wykonania zdjęcia fitosocjologicznego jest okres od połowy maja do końca sierpnia.
- W opisie zdjęcia fitosocjologicznego umieszcza się następujące informacje:
- nr powierzchni obserwacyjnej runa (przyjmuje się nr SPO II rzędu);
- datę wykonania zdjęcia;
- tymczasową nazwę zespołu wg ujęcia W. Matuszkiewicza i J.M. Matuszkiewicza; niedopuszczalne jest stosowanie innych lokalnych systemów syntaksonomicznych;
- formy degeneracji (nie wypełnia się w terenie); wyróżnia się następujące formy degeneracji:
- monotypizacja (forma degeneracji fitocenozy leśnej polegająca na ujednoliceniu wiekowym i gatunkowym jej drzewostanu);
- fruticetyzacja (forma degeneracji fitocenozy leśnej polegająca na masowym rozroście warstwy krzewów, np. masowym rozroście jeżyn lub malin pod drzewostanami sosnowymi na żyznych siedliskach);
- cespityzacja (forma degeneracji fitocenozy leśnej polegająca na masowym rozroście traw w runie, np. trzcinnika piaskowego lub śmiałka darniowego pod drzewostanami sosnowymi);
- juwenalizacja (forma degeneracji fitocenozy leśnej polegająca na utrzymywaniu zespołu roślinnego w młodym stadium rozwojowym, np. przez rytmiczne zręby zupełne i odnowienia;
- neofityzacja (forma degeneracji fitocenozy leśnej polegająca na wnikaniu do niej i zadomawianiu się gatunków obcych geograficznie, np. czeremchy amerykańskiej, robinii akacjowej, klonu jesionolistnego, niecierpka drobnokwiatowego, dębu czerwonego i innych);
- pinetyzacja (forma degeneracji fitocenozy leśnej polegająca na zjawiskach zachodzących pod wpływem uprawy drzewostanu gatunków iglastych (sosna, świerk) na siedliskach żyźniejszych niż odpowiadające im w naturze);
- imię i nazwisko osoby wykonującej zdjęcie.
- Zwarcie lub pokrycie poszczególnych warstw (A – drzew, z ewentualnym rozbiciem na podwarstwy A1, A2, A3; B – krzewów; C – roślinności zielnej; D – mchów i porostów) oraz udział powierzchni nie pokrytej roślinnością należy podawać w procentach z dokładnością do 5%, a dla pokrycia powierzchni mniejszego niż 5% stosuje się znak +.
- Średnią wysokość drzew w poszczególnych podwarstwach drzewostanu określa się na podstawie pomiaru 2-3 drzew każdego gatunku.
- W zdjęciu fitosocjologicznym uwzględnia się wszystkie gatunki roślin naczyniowych, mszaki i porosty naziemne występujące na założonej powierzchni obserwacyjnej runa (zdjęcie ma wartość tylko wtedy, gdy spis gatunków jest kompletny).
- W stosunku do roślin naczyniowych obowiązuje nazewnictwo gatunków według opracowania Mirka i in. (Mirek Z., Piękoś-Mirkowa H. Zając A, Zając M.). Krytyczna lista roślin naczyniowych Polski. Polish Botanical Studies, Guidebook Service 15.IB PAS Krakow, 1995). Nazwy mchów obowiązują z opracowania Ochyry i Szmajdy „An annotated list of Polish mosses”. Frgm. Flor. Et Geobot.1978. W stosunku do porostów obowiązuje opracowanie Fołtynowicza „A preliminary check – list of Polish lichen forming and lichenicolous fungi”. Uniwersytet Gdański 1991.
- Ilościowość gatunków należy podawać w skali 12-to stopniowej, przedstawionej poniżej:
| Stopień skali | Pokrycie powierzchni zdjęcia w % |
|---|---|
| r | <1 |
| + | 1-5 |
| 1 | 5-10 |
| 2 | 10-20 |
| 3 | 20-30 |
| 4 | 30-40 |
| 5 | 40-50 |
| 6 | 50-60 |
| 7 | 60-70 |
| 8 | 70-80 |
| 9 | 80-90 |
| 10 | 90-100 |
- Poza ilościowością należy określić żywotność gatunków wskazującą na złe lub bardzo dobre warunki bytowania (dotyczy wyłącznie gatunków runa). W zdjęciu takie gatunki wyróżnia się dodatkowymi oznaczeniami w rubryce „żywotność”: w przypadku bardzo bujnego rozwoju (wyjątkowo silnej żywotności) należy umieścić literę „b”, natomiast w przypadku obniżonej żywotności (rośliny słabe, niższe niż zazwyczaj, nie kwitnące lub kwitnące i owocujące słabo) umieścić literę „s”. Dla roślin o normalnym rozwoju nie podaje się żadnego oznaczenia.
- Porosty występujące na martwym drewnie, na pniach i gałęziach drzew oraz na skałach i kamieniach zamieszcza się poniżej głównego spisu. Ich ilościowość określa się w stosunku do powierzchni dostępnego substratu, a nie całej powierzchni monitoringowej.
- Po wykonaniu zdjęcia fitosocjologicznego na powierzchni monitoringowej runa wykonuje się spis uzupełniający, obejmujący dodatkowe gatunki występujące w najbliższym otoczeniu (do 5 m od granic powierzchni). Ich ilościowość podaje się w nawiasach, np. Oxalis acetosella (+).
- Należy zebrać egzemplarze tych gatunków roślin, których w terenie nie udało się zidentyfikować, w celu oznaczenia w terminie późniejszym choć najlepiej tego samego dnia. Gdy nie jest to możliwe, należy przygotować egzemplarze zielnikowe w celu przesłania do specjalisty.
- Mchy i porosty w sytuacjach wątpliwych obowiązkowo musi oznaczać specjalista.
- Egzemplarze gatunków roślin do oznaczeń należy zbierać na zewnątrz powierzchni monitoringowej.
- Zbierając rośliny do oznaczenia powinno się zbierać okazy dobrze rozwinięte, nie uszkodzone, w miarę możliwości małych rozmiarów oraz posiadające korzeń, łodygę, liście, kwiaty lub owoce. Należy unikać zbierania roślin zroszonych deszczem, gdyż schną powoli i łatwo czernieją. Takie okazy osuszamy przed włożeniem do bibuły lub gazety. Wybrane rośliny wykopujemy łopatką lub nożem wraz z korzeniami poza powierzchnią obserwacyjną (8 kwadratów). Z drzew i krzewów zbiera się kwitnące i owocujące gałązki z liśćmi. Siewki zbiera się w całości.
- Zebrane okazy roślin naczyniowych konserwuje się przez zasuszenie w złożonych gazetach lub specjalnych bibułach. Rośliny wysokie zginamy w ten sposób, żeby zmieściły się na arkuszu. Każdy okaz (egzemplarz roślin) musi posiadać etykietę zawierającą następujące informacje:
- datę zebrania,
- nr powierzchni monitoringowej,
- nazwę opisową (taką samą jak w terenowej, brudnopisowej wersji zdjęcia fitosocjologicznego) oraz ilościowość,
- nazwisko i podpis osoby zbierającej.
- Ułożone w stos arkusze gazet (bibuł) umieszcza się w odpowiednich praskach (druciane siatki lub teczki z grubego kartonu) i związuje sznurkiem.
- Mchy i porosty (całe, nie uszkodzone, z wszystkimi częściami morfologicznymi) wraz z fragmentami podłoża (np. kora, martwe drewno) należy zbierać do torebek papierowych. W przypadku silnego wysuszenia porostów można je delikatnie skropić wodą, co zapobiega kruszeniu się. Każdą torebkę należy zaopatrzyć w etykietkę obejmującą następujące informacje:
- datę zebrania,
- nr powierzchni monitoringowej,
- nazwę opisową taką samą jak w terenowej, brudnopisowej wersji zdjęcia fitosocjologicznego) oraz ilościowość,
- rodzaj podłoża, na którym występuje zebrany porost.
- nazwisko i podpis osoby zbierającej
- Zebrane rośliny zielne oraz mchy i porosty należy jak najszybciej przekazać do oznaczenia na adres osoby uzgodnionej z Instytutem Badawczym Leśnictwa.
Ilościowa ocena występowania porostów na korze drzew
- Drzewa do obserwacji porostów wybiera się:
- w drzewostanach jednogatunkowych – 3 żywe drzewa o nieuszkodzonej korze,
- w drzewostanach wielogatunkowych – 3 drzewa z gatunku panującego oraz po jednym drzewie z gatunków domieszkowych (występujących w składzie). W obu przypadkach drzewa mogą być zróżnicowane pod względem wieku, wysokości, pierśnicy i pozycji biosocjalnej. W przypadku obumarcia wybranego drzewa należy je pozostawić w serii pomiarowej, z zaznaczeniem w protokole obserwacyjnym.
- Wybrane drzewa należy trwale oznakować farbą, nadając im kolejne duże litery alfabetu A, B, C itd. Drzewa te należy wybierać z pominięciem drzew dotychczas zanumerowanych.
- Do ilościowej oceny porostów na pniach służy ramka zawieszana (tylko na czas pomiaru) na wyznaczonych drzewach (fot. 2) na wysokości około 1,7 m. Ramka ma być wykonana z białego elastycznego tworzywa. Pole obserwacyjne ramki ma wymiary 20 cm (poziomo) na 30 cm (pionowo).
- Ocena polega na określeniu z dokładnością do 5% powierzchni kory zajętej przez porosty w obrębie pola obserwacyjnego ramki. Ponadto określa się również gatunek dominujący oraz ogólną liczbę gatunków porostów w obrębie pola obserwacyjnego.
- Ogólną liczbę gatunków przedstawia się za pomocą następującej skali uproszczonej:
| Kod | Liczba gatunków |
|---|---|
| 1 | Jeden gatunek |
| 2 | 2-5 gatunków |
| 3 | Ponad 5 gatunków |
- Porosty do oznaczenia należy brać z tego samego drzewa, ale z miejsca poza ramką. Na etykiecie należy zaznaczyć numer drzewa, z którego pobrano próbę.
- Niezbędną dokumentację stanowią zdjęcia fotograficzne. Zdjęcia należy wykonywać z odległości nie większej niż 150 cm prostopadle do powierzchni tak, aby w kadrze znalazła się cała ramka oraz fragmenty pnia powyżej i poniżej ramki.
- Przed wykonaniem każdego zdjęcia w dolnej części ramki należy czytelnie napisać (najlepiej ścieralnym czarnym flamastrem): a) datę, b) nr powierzchni monitoringowej, c) nr drzewa.

Fot. 2. Ramka do ilościowej oceny występowania porostów na korze drzew
Struktura pozioma runa
A. Wykonanie zdjęć fitosocjologicznych na kwadratach 2x2 m (ryc. 2)
- Strukturę poziomą runa analizuje się na powierzchni 100 m2 (podpowierzchnia nr 1, 10x10 m,) głównej powierzchni monitoringowej runa wielkości 400 m2.
- Lewy górny róg podpowierzchni jest jednocześnie lewym górnym rogiem powierzchni głównej. Granice podpowierzchni zostały trwale oznakowane wbitymi kołkami w trakcie wytyczania powierzchni głównej.
- Oznakowaną podpowierzchnię dzieli się na 25 kwadratów wielkości 4 m2 (2x2 m).
- Podział przeprowadza się za pomocą szpilek metalowych (lub plastikowych), sznurka i taśmy mierniczej, na każdym boku podpowierzchni wbija się szpilki co 2 m. Odpowiednie szpilki na przeciwległych bokach łączy się sznurkiem.
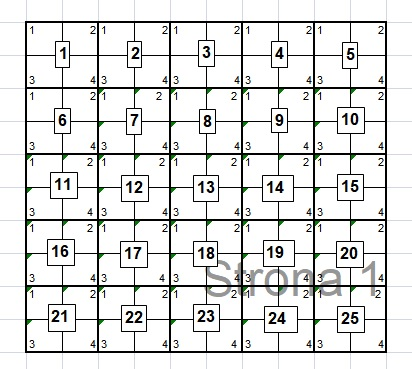
Rycina 2.3. Schemat podziału podpowierzchni 1 na 25 kwadratów 2 x 2 m oraz każdego z kwadratów na 4 mniejsze kwadraty o boku 1 m
- Kwadraty numeruje się następująco: kwadrat w lewym górnym rogu otrzymuje nr l, kolejny w prawo – numer 2 aż do 5, pierwszy z lewej w następnym rzędzie – nr 6, ostatni w prawym dolnym rogu – nr 2.5 (patrz rycina 1, szkic powierzchni).
- Dla każdego z kwadratów wykonuje się „mini” zdjęcie fitosocjologiczne, uwzględniając krzewy, rośliny runa i warstwę mchów i porostów (natomiast bez uwzględnienia gatunków drzewostanu).
- W przypadku wystąpienia gatunków nieznanych (nie oznaczonych w terenie) wpisuje się nazwę opisową, tymczasową, taką samą jak w podstawowym zdjęciu fitosocjologicznym i na (ewentualnym) arkuszu zielnikowym do oznaczenia.
- Ponadto określa się następujące informacje: a) datę opisu, b) informacje o wykonawcy, c) procent powierzchni kwadratu zajęty przez pnie drzew, d) procent powierzchni kwadratu zajęty przez krzewy, e) procent powierzchni kwadratu zajęty przez rośliny runa, f) procent powierzchni kwadratu zajęty przez warstwę mchów, g) procent powierzchni nie pokryty roślinnością, h) czy kwadrat jest pod koroną drzewa (znak +) czy w luce między koronami (znak -). Następnie wpisuje się gatunki występujące w danym kwadracie. Stosuje się 12-to stopniową skalę ilościowości (odniesioną do powierzchni: 1m2). Dodatkowo – w uwagach – można wpisać informację o bujności i żywotności gatunków, szczególnie w przypadku, gdy odbiegają one od normy.
B. Agregacja form gatunków
- Każdy z wytyczonych kwadratów o boku 2 m należy podzielić wizualnie na 4 kwadraty o boku 1 m w celu określenia na ich powierzchni agregacji form gatunków dominujących.
Agregację: form gatunków dokonuje się na podstawie obserwacji wizualnych i zaznacza się za pomocą kodów literowych. Kwadraty numeruje się następująco: kwadrat w lewym górnym rogu każdego kwadratu o boku 2 m otrzymuje nr 1, w prawym górnym rogu – numer 2, w lewym dolnym rogu – numer 3 i w prawym dolnym rogu – numer 4 (np. pełny zapis numeru kwadratu 1 m2 w dolnym prawym rogu kwadratu 16 powinien być 16.4).
- Przyjmuje się następujące kody dla poszczególnych form gatunków:
| Kod | Forma gatunku |
|---|---|
| A | Brak roślin (powierzchnia bez roślin powyżej 95%) |
| B | Mchy |
| C | Porosty |
| D | Trawiaste |
| E | Dwuliścienne zielne |
| F | Krzewinki |
| G | Siewki drzew |
- W przypadku występowania w jednym kwadracie dwóch dominujących form (np. mchy i krzewinki) stosuje się podwójne oznaczenia (np. BF).
- Wyróżnia się agregacje zwarte i luźne. Agregacje zwarte pokrywają ponad 50% powierzchni kwadratu. Oznacza się je literami dużymi/ Agregacje luźne pokrywają od 5 do 50% powierzchni kwadratu. Oznacza się je odpowiednimi małymi literami.
Ocena odnowienia naturalnego
- Ocenę odnowień naturalnych drzewostanów dokonuje się na SPO II rzędu w drzewostanach sosnowych i świerkowych dębowych i bukowych.
- Obserwację odnowienia naturalnego prowadzi się na kwadratach nr 2, 3, 5, 8. Kwadraty te podzielona są na 16 poletek o wymiarach 2,5x2,5 m. Poletka oznaczone są kolejnymi numerami od 1 do 16 poczynając od górnego lewego rogu do prawego dolnego rogu, zaczynając numeracje każdego rzędu od lewej strony. Numer poletka składa się z pierwszej cyfry oznaczającej numer kwadratu i dwu kolejnych cyfr oznaczającej numer poletka np. 312 lub 802.
- Ocena liczebności występowania nalotu i podrostu
- odnowienie naturalne dzieli się na nalot, młodszy podrost, starszy podrost,
- nalot stanowią drzewka do 0,5 m wysokości, młodszy podrost stanowią drzewka od 0,5 m do 1,3 m wysokości, starszy podrost stanowią drzewka o wysokości ponad 1,3 m do grubości pierśnicy 7 cm,
- w grupie drzewek do 1,3 m wysokości należy wyróżnić w odrębnej kategorii podsadzenia,
- ocenę liczebności i strukturę powierzchniową rozkładu przeprowadza się indywidualnie na każdym poletku w czterech wyznaczonych uprzednio kwadratach.
- na każdym poletku określa się ilościowość nalotu w skali 12-to stopniowej, oddzielnie dla każdego występującego gatunku drzewa wg poniższej skali:
- Ocena liczebności występowania nalotu i podrostu
Stopień skali pokrycie terenu w procentach
| Kod | Zakres procentowy (%) |
|---|---|
| r | < 1 |
| + | 1 – 5 |
| 1 | 5 – 10 |
| 2 | 10 – 20 |
| 3 | 20 – 30 |
| 4 | 30 – 40 |
| 5 | 40 – 50 |
| 6 | 50 – 60 |
| 7 | 60 – 70 |
| 8 | 70 – 80 |
| 9 | 80 – 90 |
| 10 | 90 – 100 |
– dla każdego poletka podaje się liczbę drzewek podrostu młodszego i starszego, podsadzeń oraz drzew rosnących na poletku wg gatunku
b) ocena zakresu wiekowego i żywotności odnowień naturalnych
- na każdym poletku określamy średni wiek nalotu oraz młodszego i starszego podrostu z 10-ciu losowo wybranych drzewek. W przypadku gatunków iglastych wiek określamy licząc okółki i dodając 2 lata dla odnowienia sosnowego i 3 lata dla odnowienia świerkowego. Wiek drzewek gatunków liściastych określamy szacunkowo.
- klasę żywotności nalotu, podrostu i podsadzeń określamy na podstawie cech wzrokowych takich jak pokrój korony, jej długość, barwa igliwia oraz stosunek długości pędu głównego do długości pędów bocznych. Podobne cechy wykorzystuje się. przy ocenie żywotności drzewek liściastych;
- wyróżnia się cztery klasy żywotności:
| Klasa żywotności | Opis |
|---|---|
| 1 | Drzewka bujnie rosnące o pędzie głównym co najmniej tak długim jak pędy boczne |
| 2 | Drzewka normalnie rozwinięte o pędzie głównym wynoszącym od ½ do 1/1 długości pędu bocznego |
| 3 | Drzewka osłabione o pędzie głównym wynoszącym ¼ do ½ długości pędu bocznego |
| 4 | Drzewka zamierające, zahamowane we wzroście, o pędzie głównym wynoszącym do ¼ długości pędów bocznych lub pozbawione przyrostu wysokości |
- klasę żywotności określa się dla nalotu jako średnią określoną na 10-ciu losowo wybranych drzewkach zaokrąglając wartość klasy do jednej dziesiętnej,
- klasę żywotności dla młodszego i starszego podrostu oraz podsadzeń określa się w taki sam sposób. Jeżeli liczba drzewek jest mniejsza od 10-ciu w poletku, średnią klasę żywotności określa się na podstawie oceny wszystkich rosnących drzewek
c) opis parametrów drzewostanu. Na każdym poletku określa się liczbę drzew każdego gatunku o pierśnicy powyżej 7 cm. Dla każdego poletka oddzielnie określa się pokrycie (rzut koron na powierzchnię), dla całego kwadratu określa się zwarcie drzewostanu w procentach z dokładnością do 10%.
d) typ. pokrywy gleby określa się jak w instrukcji urządzania lasu to jest:
- 1 – naga
- 2 – ściółka
- 3 – zazieleniona
- 4 – mszysta
- 5 – zadarniona
- 6 – silnie zadarniona
- 7 – zdziczała